| |
Objectius |
| |
|
| |
Els objectius d'aquesta pràctica són:
- Fer una valoració fent ús de les noves tecnologies.
- Obtenir una corba de valoració d'una base forta amb un àcid
fort.
- Determinar la concentració de base amb un àcid fort
de concentració coneguda
|
| |
|
 |
Quantitat d'àcid acetilsalicílic
en una aspirina |
| |
|
| |
Introducció |
| |
|
| |
Les valoracions àcid-base són tècniques analítiques
de laboratori basades en les reaccions àcid-base. El punt final
d'una valoració, la neutralització, es pot detectar mitjançant
un indicador. Les noves tecnologies permeten visualitzar la gràfica
d'una valoració, amb l'ordinador, amb molta precisió i sense
necessitat d'utilitzar un indicador.
Per saber la quantitat d'àcid acetilsalicílic que hi ha
en una píndola d'aspirina, poseu la píndola amb un excés
d'hidròxid de sodi i valoreu amb àcid clorhídric
l'excés d'hidròxid sòdic que no ha reaccionat. La
reacció de l'àcid acetilsalicílic amb l'hidròxid
de sodi és:
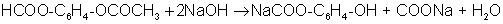
|
| |
|
 |
Material i equipament |
| |
|
| |
|
Equipament
MultiLog
- Consola
- Sensor de pH complet
- Ordinador amb el MultiLab
|
Reactius
i altres materials
- Píndola d'una aspirina
- Dissolució alcohòlica de fenolftaleïna a
l'1 %
- Hidròxid de sodi 1M
- Àcid clorhídric 1M
- Vas de precipitats de 100 ml
- Bureta de 50 ml
- Embut petit
- Suport metàl·lic amb pinces i nous
(No imprescindible)
- Agitador magnètic i imant
|
|
| |
|
 |
Procediment |
| |
|
| |
Muntatge de l'experiència |
| |
|
| |
Fareu reaccionar tot l'àcid que conté la píndola
amb l'hidròxid de sodi que hi posareu amb excés.
Per saber la quantitat d'hidròxid de sodi que ha sobrat, feu una
valoració amb àcid clorhídric.
- Peseu l'aspirina i anoteu-ne el pes.
- Poseu l'aspirina en un vas de precipitats de 100 ml.
- Afegiu 10 ml d'hidròxid de sodi 1M i deixeu l'aspirina en digestió
durant 10 minuts.
- Afegiu-hi uns 20 ml d'aigua destil·lada
i unes gotes de fenolftaleïna.
|
| |
 |
- Subjecteu la bureta al suport metàl·lic amb
la pinça i ompliu-la amb l'ajut de l'embut, d'àcid
clorhídric 1M i enraseu-la.
- Agafeu el vas de precipitats de
100 ml amb l'excés d'hidròxid de sodi, poseu-hi
l'imant i poseu-lo sobre l'agitador magnètic (en cas
de tenir-ne).
|
|
| |
 |
- Col·loqueu la sonda del pHmetre dins del vas de precipitats,
evitant que l'extrem toqui al fons o a l'imant, i subjecteu-la
amb una pinça al suport metàl·lic.
|
|
| |
|
| |
Configuració de l'equip |
| |
|
| |
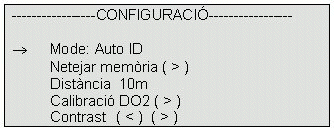
1. Configuració del MultiLogPRO
- Obriu la consola
 . .
- Connecteu-la al port USB de l'ordinador i a la font d'alimentació.
- Amb
 desplaceu-vos fins a Configuració sistema
desplaceu-vos fins a Configuració sistema  .
Premeu Enter .
Premeu Enter  . .
- Us apareixerà la pantalla següent:
- Amb
 seleccioneu Mode: Auto ID.
seleccioneu Mode: Auto ID.
- Premeu
 i la netegeu la memòria; premeu
i la netegeu la memòria; premeu  i us apareixerà el missatge Memòria neta!
i us apareixerà el missatge Memòria neta!
- Premeu
 per tornar al menú principal.
per tornar al menú principal.
- Endolleu el sensor de pH a l'adaptador.
- Connecteu l'adaptador del sensor de pH al port I/O 1 de la consola.
|
| |
- Poseu en marxa l'agitador.
|
 |
Si feu la pràctica sense
agitador, recordeu que cal remenar uns 10 s cada cop després d'afegir
el volum d'HCl. |
| |
|
| |
2. Configuració del MultiLab
- Obriu el programa MultiLab
 i tanqueu totes les finestres menys la de gràfic.
i tanqueu totes les finestres menys la de gràfic.
- Obriu Configuració
 i us apareixerà la pantalla següent:
i us apareixerà la pantalla següent:
|
| |
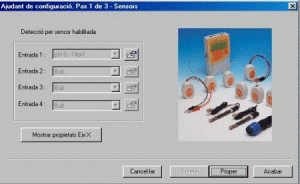 |
- Comproveu que a l'Entrada 1 us apareix Ph
0 - 14pH.
- Premeu Proper i us apareixerà la pantalla següent:
|
| |
|
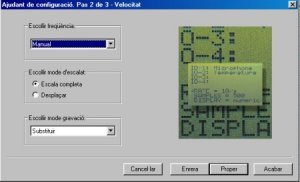 |
- Seleccioneu Escull freqüència i Manual.
- Seleccioneu Escala completa a Mode d'escalat.
- Seleccioneu Substitueix a Mode de gravació.
- Premeu Proper i us apareixerà la pantalla següent:
|
| |
|
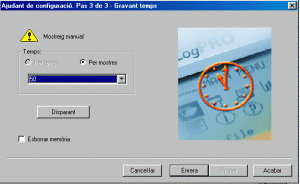 |
- Obriu Temps i seleccioneu Per mostres.
- Trieu 50.
- Premeu Acaba.
|
|
| |
|
| |
3. Preparació de la taula |
| |
|
| |
Seguidament preparareu la taula en
la qual introduireu els valors d'àcid HCl afegit a la solució
de NaOH. |
| |
|
| |
|
 |
Enregistrament i transformació
de dades |
| |
|
| |
Captació de dades |
| |
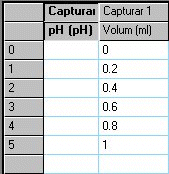 |
- Poseu-hi 50 valors, de 0,2 en 0,2 ml, fins a arribar a 10 ml.
|
|
| |
|
| |
- Comenceu la captació clicant al botó Executa
 . .
|
| |
 |
Primera dada per al volum inicial de 0 ml:
- Cliqueu al botó Eina de captura
 :
el valor del pH de la solució inicial d'hidròxid
de sodi queda enregistrat. :
el valor del pH de la solució inicial d'hidròxid
de sodi queda enregistrat.
|
|
| |
|
| |
La segona dada i successives fins
a 200 ml: |
| |
- Deixeu caure 0,2 ml d'àcid clorhídric i espereu uns
10 ml.
- Premeu el botó Enter
 de la interfície i a continuació cliqueu al botó
Eina de captura
de la interfície i a continuació cliqueu al botó
Eina de captura  . .
- Aneu repetint aquest procés fins a acabar les 50 captacions.
Ara només us cal prémer el botó Stop
 i finalitzareu les captacions.
i finalitzareu les captacions.
|
| |
|
| |
- Seleccioneu el Mapa de dades al Conjunt dades; obriu
Capturar1 i activeu pH.
- Obtindreu una gràfica semblant a la següent:
|
| |
|
| |
|
| |
|
| |
Transformació de les dades |
| |
|
| |
Per tenir una gràfica de l'evolució del pH en funció
del volum feu el següent:
- Cliqueu a Edita gràfic
 de la barra d'eines del gràfic: us apareixerà finestra
següent
de la barra d'eines del gràfic: us apareixerà finestra
següent
de la qual seleccionareu els conjunts de valors que han
d'aparèixer representats als eixos:
A l'eix de les x: captura 1 (volum)
A l'eix de les y: captura 1 (pH)
|
| |
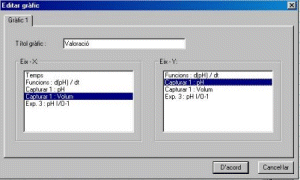 |
- Anomeneu el gràfic Valoració.
- Seleccioneu els conjunts de valors que han d'aparèixer
representats als eixos:
A Eix-X trieu Captura1 (Volum)
A Eix-Y seleccioneu Captura 1 (pH)
- A continuació, cliqueu a D'acord
i obtindreu la gràfica següent:
|
|
| |
|
|
|
| |
|
| |
- Copieu la gràfica en un arxiu del Word, doneu-li el nom de
Valoració i guardeu-lo a la carpeta m6a. Més
endavant l'enviareu al tutor/a.
|
| |
|
 |
Anàlisi de dades i conclusions
experimentals |
| |
|
| |
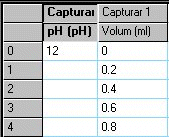
Al principi la solució es
bàsica, pH = 12. A partir d'uns 4 ml veureu que el pH comença
a canviar passant a ser àcid. |
| |
|
| |
Per trobar el punt d'equivalència, on podeu dir que s'ha neutralitzat
la base, feu ús de la derivada.
- Cliqueu al botó Derivada
 de la barra d'eines principal i obteniu la gràfica següent:
de la barra d'eines principal i obteniu la gràfica següent:
|
| |
|
| |
|
| |
|
| |
- Copieu la gràfica a l'arxiu del Word Valoració
que teniu a la carpeta m6a i torneu-lo a guardar. Més
endavant l'enviareu al tutor/a.
|
|
|
 |
- A la funció derivada, el punt d'inflexió correspon
a un volum d'àcid de 4 ml. Per tant, han reaccionat 6 ml de NaOH
1 M amb l'àcid acetilsalicílic; és a dir, 0,006
mols de NaOH, i tenint en compte la reacció 0,003 mols d' acetilsalicílic.
Aquest nombre de mols correspon a 0,54 g.
- Si teniu en compte que la píndola pesava 0,62 g, es pot
dir que l'aspirina té un 87,09 % d'àcid acetilsalicílic.
|
| |
|
| |
- Feu el càlcul en tant per cent d'àcid acetilsalicílic
de l'aspirina, i guardeu l'arxiu del Word a la carpeta m6a amb
el nom d'aspirina. Més endavant l'enviareu al tutor/a.
|
| |
|
| |
| Descàrrega de la pràctica
en format Word |
 |
|
| |
|
| |
|
 |
| |
|